文章来源:老千和他的朋友们???
原文作者:孙千???
本文主要介绍锂离子电池技术。??????
锂离子电池的起源
化学元素锂于1817年由Johan August Arfwedson通过分析矿物锂长石(LiAlSi?O??)发现,并于1818年由J?ns Jakob Berzelius首次报道。1821年,William Thomas Brande通过电解锂氧化物(Li?O)成功分离出锂。
Lewis和Keyes于1913年通过锂/汞金属间化合物开始研究锂金属的电化学性质。在丙胺溶液中的LiI中,测量了锂、锂/汞金属间化合物和甘汞(Hg?Cl?)电极之间的相对电位。锂金属的电位为3.3044V(相对于甘汞),被描述为"迄今为止测得的最高电极电位"。这一说法至今仍然成立,并为所有现代基于锂金属或锂衍生物的电池研究奠定了基础。
对高能锂基电池的追求始于20世纪50年代。1958年,由于使用锂时必须避免水和空气(因其具有反应性),William S. Harris研究了盐在各种非水电解质中的溶解度和导电性——包括环状酯(碳酸乙烯酯、碳酸丙烯酯、γ-丁内酯和γ-戊内酯)、熔融盐和溶解在碳酸丙烯酯中的无机锂盐(LiClO?)。他观察到形成了一种钝化层,能够防止锂与电解质之间的直接化学反应,同时仍允许离子传输,这导致了对锂离子电池稳定性的研究。这些研究也增加了对一次性锂离子电池商业化的兴趣。
自20世纪60年代末以来,非水性3V锂离子一次电池已经在市场上出现,使用不同的正极,包括锂-二氧化硫电池、锂-一氟化碳电池、锂-二氧化锰电池和锂-卤素电池。同时,对使用不同材料的锂离子一次电池的理解进步催生了可充电(二次)锂离子电池。一些综述论文中也可以看到最终导致锂离子电池诞生的关键发现和技术成就的广泛描述。
锂离子电池的历史??
室温下可充电锂离子电池的广泛研究始于20世纪70年代初,在发现了能量储存中的嵌入反应之后。在化学中,嵌入是离子或分子可逆地插入晶格结构而不显著改变晶格结构的过程,除了轻微的膨胀或收缩。最初,研究人员通过将离子或有机分子嵌入到主体材料的结构中,修改载流子密度,从而创造了超导体。
M.Stanley Whittingham展示了第一个可充电锂离子电池,使用层状TiS?作为正极,锂金属作为负极,以及二氧戊环中的LiClO?作为电解质。在展示基于TiS?的锂离子电池之后,各个研究小组研究了不同的金属硫族化物作为锂离子电池的电极材料。
事实上,大多数锂离子电池在两个电极上都利用嵌入反应进行能量储存,表明基础技术在近40年内没有改变。此外,锂-铝(Al)合金被用作负极,它是通过将锂片放在铝片顶部形成的。在电池构建的最后阶段,在电池密封前,添加电解质,使锂和铝片之间的反应形成锂-铝合金。
1980年,John Goodenough首次提出利用层状钴酸锂(LiCoO?)作为高能量和高电压正极材料。1983年,Goodenough还确定了锰尖晶石(LiMn?O?)作为低成本正极材料。然而,缺乏安全的负极材料限制了层状氧化物正极在锂离子电池中的应用。1987年,Yohsino等人申请了专利并建造了使用碳质负极和LiCoO?正极的原型电池。碳负极和LiCoO?正极在空气中都很稳定,这对工程和制造非常有利。
索尼在20世纪90年代初成功将第一款基于碳负极(石油焦)和LiCoO?正极的可充电锂离子电池商业化。设计的电池展示了>3.6V的开路电压和约150 Wh/kg的能量密度。从那时起,很多研究一直在进行并且仍在进行中,以改善电极材料的性能。
锂离子电池的基本结构
虽然探索了各种类型的电极材料、电解质和隔膜,但锂离子电池的基本设计仍与M. Stanley Whittingham在1976年提出的相同。通常,锂离子电池主要由正极和负极材料、集流体、电解质和隔膜组成。
为了将正极和负极材料(通常称为活性材料)涂覆在集流体上,通常先制备浆料。浆料是通过将液体溶剂、聚合物粘合剂、导电添加剂和活性材料混排在一起制备的。正极和负极通过隔膜相互隔离。隔膜在电极之间提供电绝缘,同时允许锂离子在电解质相中通过隔膜传输。
原则上,电解质应该具有离子导电性和电子绝缘性;然而,电解质的实际行为要复杂得多。嵌入/脱嵌是可充电电池中最经典的电荷储存机制。
在石墨负极和LiCoO?正极的情况下,如图1所示,在充电过程中,锂离子从层状LiCoO?主体中脱嵌,穿过电解质并嵌入石墨层之间。这一过程在放电过程中逆转。充放电过程中的电化学反应可以简要描述如下:
正极:LiCoO? Li???CoO? + xLi? + xe?
负极:6C + xLi? + xe? Li?C?
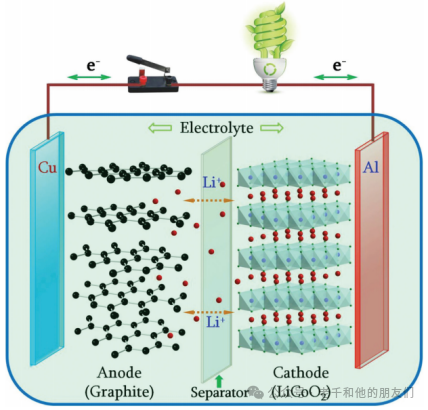
图1锂离子电池结构示意图
锂离子电池的尺寸取决于应用和功率规格。锂离子电池有不同形式,如纽扣电池、圆柱形电池、棱柱形电池和袋装电池(图2)。纽扣电池主要用于不可充电的便携设备,包括医疗植入物、手表、助听器、汽车钥匙和内存备份。圆柱形电池的典型应用是电动工具、医疗仪器、笔记本电脑和电动自行车。棱柱形电池主要用于手机、平板电脑和薄型笔记本电脑。袋装电池为电池设计提供了简单、灵活和轻量级的解决方案。
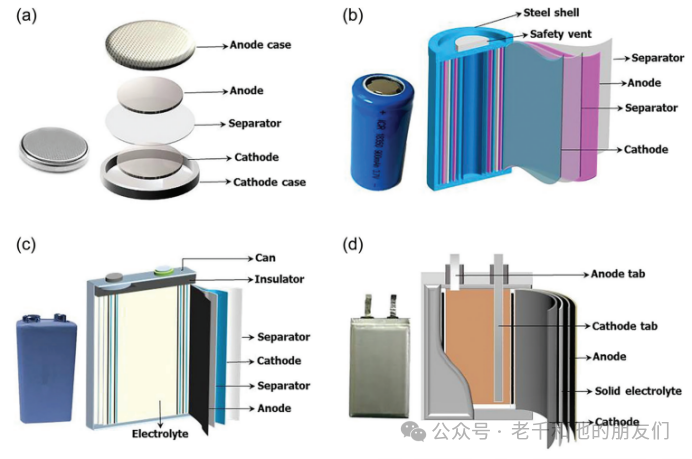
图2 典型可充电电池配置的示意图:(a)纽扣型,(b)圆柱型,(c)棱柱型和(d)软包型。
超越锂离子电池
尽管新型电池技术可能无法在市场份额上直接与锂离子电池竞争,因为它们在性能、成本和尺寸方面具有独特特性,但一些有前途的电池系统正在为未来应用而开发。
为了开发高能量密度的电池,锂硫(Li-S)和锂空气(Li-O?)电池因其最高的理论能量密度而受到广泛的研究关注。由于非锂金属比锂更丰富,非锂金属离子电池也已经出现并在能源存储应用中显示出巨大潜力。例如,钠离子电池(SIBs)是最有前途的"超越锂"能源存储技术之一,因为锂离子电池的大部分专业知识可以直接用于钠离子电池的开发。同样,镁离子电池(MIBs)通过避免枝晶形成而具有增强安全性的优势,并且在显著降低成本的同时能够达到与锂离子电池相当的能量密度。此外,锌离子电池(ZIBs)可以被视为电网能源存储最有前途的替代方案之一。最后,铝离子电池(AIBs)通过三电子转移反应,理论上可以实现比锂离子电池高三倍的能量密度。由于丰富的铝资源和低成本,铝离子电池已成为最有前景的下一代电池系统之一。
锂离子电池的正极材料
作为锂离子电池的关键组成部分,高能量密度、长循环寿命和高安全性的正极材料备受青睐。与石墨负极相比,正极的相对较低容量已成为提高锂离子电池能量密度的瓶颈。因此,已经进行了大量研究来探索具有高能量密度的先进正极材料。
此外,锂离子电池的其他关键性能参数,包括倍率性能和循环寿命,也至关重要,这些由正极材料的内在化学特性决定。例如,倍率性能与正极材料的电子和离子导电性高度相关,而循环寿命则强烈受到正极材料成分和充电状态的影响。锂离子电池的正极材料可分为几类,即层状正极、尖晶石正极、多阴离子正极、无序岩盐型正极、转化型正极、硫和氧气正极。
层状正极
层状正极以特定结构为特征,由锂离子和金属化合物的交替层组成。层状结构是锂离子电池正极材料中最早形式的嵌入化合物。金属硫族化合物最先被研究作为可能的嵌入式正极。二硫化钛(TiS?),一种具有锂嵌入位点的六方密堆结构,因其高能量密度(约130 Wh/kg或280 Wh/L)和延长的循环寿命而被广泛研究。
图3显示了LiTiS?化合物的层状结构,锂离子可以在过渡金属硫化物层之间嵌入。LiTiS?嵌入化合物是嵌入的理想例子,在x从0到1的所有值范围内显示锂的完全溶解度。图3还显示了在电流密度为10mA/cm?时LiTiS?的充放电曲线。
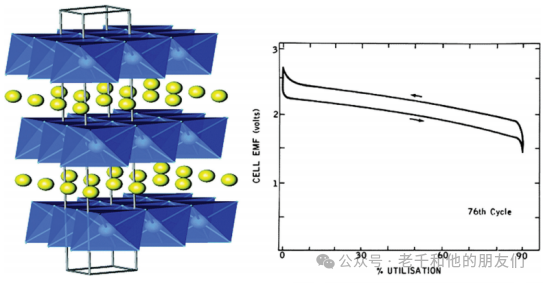
图3(左)LiTiS?的层状结构。(右)在电流密度为10mA/cm?时Li/TiS?的充放电曲线。
五氧化二钒(V?O?)和三氧化钼(MoO?)是最早研究用于可充电锂电池的两种层状过渡金属氧化物(TMOs)。与层状二硫族化物具有相同结构的层状过渡金属氧化物因其高电压和高能量密度而被最广泛研究。
层状钴酸锂(LiCoO?,LCO)是第一种被广泛研究和商业成功的层状过渡金属氧化物正极。LCO由John Goodenough认识并引入,由索尼商业化,与碳质负极结合制造锂离子电池。
一价锂离子和三价钴离子在岩盐结构的氧化物离子立方密堆阵列的交替(111)平面上有序排列。位于八面体位置的钴和锂占据交替层并形成六方对称性。LCO显示相对高的理论比容量274mAh/g和高的理论体积容量1,363 mAh/cm?。然而,当从层状晶格中提取超过一半的锂离子(x>0.5)时,Li???CoO?会发生一系列不可逆的结构转变,导致不可逆容量损失。通常,元素掺杂、表面涂层和共同修饰可以有效提高结构稳定性并促进循环稳定性。如今,商业LCO的实际比容量可达185mAh/g,对应于4.5V的充电截止电压。
LiNiO?(LNO)具有与LiCoO?相同的晶体结构和相似的理论比容量275mAh/g。在Jeff Dahn等人的努力下,相对较高的能量密度和低成本推动了对LNO的研究。纯LNO难以合成,大多数报告建议过量的镍,如Li???Ni???O?,其中Ni??离子在合成甚至脱锂过程中倾向于取代Li?位点。实际上,这种锂/镍混排是高镍层状氧化物中一个臭名昭著的内在问题。此外,LNO还遭受有害的结构转变,阻塞锂离子扩散通道,导致循环性能不佳,并且由于高效的平衡氧分压,在低锂含量时显示出较差的热稳定性。
结合镍和钴,研究人员发现LiNi???Co?O?是减少阳离子无序和增加热稳定性的有效方法。此外,与LNO相比,LiNi???Co?O?相更容易制备,不需要使用氧气氛围。
另外,研究LiMnO?(LMO)是因为锰比钴或镍便宜得多且毒性较低。纯LiMnO?正极在锂离子电池中的实际使用受到阻碍,这是由于与高自旋Mn??相关的协同杨-泰勒(John–Teller)效应,导致严重的结构退化和快速的容量衰减。结合镍和锰,一种有趣的材料是LiNi?.?Mn?.?O?,在2.5V-4.3V的电压范围内提供稳定的容量160mAh/g。
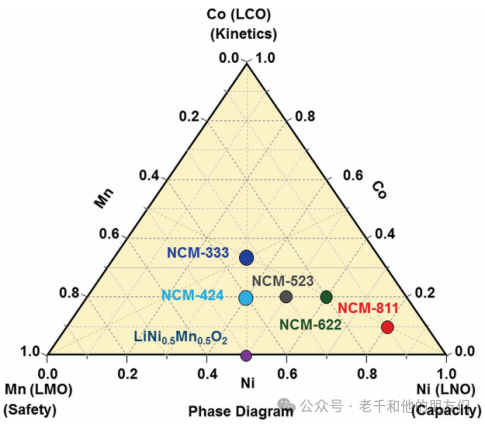
为了解决LCO和LNO的热不稳定性,层状三元过渡金属氧化物,如LiNi?????Co?Mn?O?(NMC)和LiNi?????Co?Al?O?(NCA),在可逆容量、倍率性能和成本效益方面是最实用的广泛应用候选者。NMC可以被视为LiNiO?、LiCoO?和LiMnO?的固溶体。图4展示了三种单独锂化氧化物(LiNiO?、LiCoO?和LiMnO?)的相图,具有镍、钴和锰的各种成分。
图
4 由LNO、LCO和LMO生成的三元系统相图,显示了一些代表性成分。
在三元金属氧化物的结构中,每种金属元素执行其功能并提供协同效应。在NMC中引入锰和在NCA中引入铝可以保持结构稳定性并降低成本。镍允许高锂提取并提供高容量,而钴防止镍占据锂位点,从而保证高可逆容量。
对NMC正极的研究始于不同团队的低镍含量。2001年,Ohzuku和Makimura合成并表征了LiNi?.??Mn?.??Co?.??O?(NMC111),而Jeff Dahn及其同事研究了LiNi?Co????Mn?O?(x = 0.25和0.375)。此后,一系列NMC被开发和商业化,包括NMC422、NMC532、NMC622和NMC811。
镍含量的增加提高了电荷存储容量。例如,NMC811显示200mAh/g的可逆容量,而NMC111仅显示150mAh/g的较低容量。然而,由于高镍NMC不稳定的材料特性,容量衰减和热不稳定性加剧。Ni??离子对液体有机电解质和微量水分的不稳定性增加了正极材料的反应活性。
表面涂层和部分元素替代是克服性能退化最常见和有效的方法。表面涂层可以减少电解质和正极材料之间的反应,而元素替代可以影响电子结构以稳定材料并防止在锂移除过程中结构崩塌。例如,研究人员合成了铌(Nb)涂层和替代的NMC811以改善电化学性能。铌涂层稳定了表面,减少了首次循环损失并提高了倍率性能,而铌替代通过稳定晶格结构改善了长时间循环的容量保持率。
与NMC类似,NCA也可以被视为LiNiO?、LiCoO?和LiAlO?的固溶体。NCA最流行的配方是LiNi?.?Co?.??Al?.??O?,显示出与NMC811相当的比容量200mAh/g。需要注意的是,NCA中第三种金属(Al:5%-10%)的含量相对较低,远低于NMC中的锰(10%-40%)。这是因为使用更高水平的铝(>10%)会导致严重的容量衰减和结构中锂离子扩散性能下降。
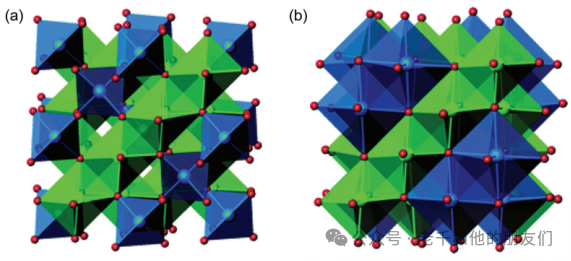
富锂层状氧化物,尤其是富锂锰基正极材料(xLi?MnO?·(1–x)LiMO?,0
图5 (a)菱方LiMO2相(空间群:R-3m,M = Ni, Co, Mn)和(b)单斜Li2MO3相(空间群:C2/m)的晶体结构
如前文所述,正极含有过渡金属离子,即Mn、Ni和Co。过渡金属离子从正极溶解到电解质中并最终沉积在负极上是不可避免的,尤其是在高温和高电池电压条件下。过渡金属离子的溶解是锂离子电池容量和功率衰减的主要原因之一。
过渡金属离子的溶解是酸碱反应,如电解质中发现的微量HF所致。这些反应导致在正极表面形成电子和离子绝缘的LiF,并导致过渡金属离子溶解。此外,在高温和高电池电压下也可能产生此类酸性物质。为解决和消除过渡金属离子溶解问题,广泛使用了两种策略。一是稳定正极材料的结构:(i)表面涂层可提供化学惰性层进行保护;(ii)阳离子和阴离子在体相层面的替代也已被广泛应用,以调整晶体化学特性从而获得更稳定的正极材料。另一种是添加电解质添加剂,以清除电解质中的水和/或HF杂质。
尖晶石结构正极材料
尖晶石结构的正极提供了一个消除钴的机会。它们廉价且环保,由于存在三维(3D)锂离子扩散通道,还具有优异的倍率性能。最广泛研究的尖晶石正极是LiMn?O?。LiMn?O?的实际比容量约为120mAh/g,理论比容量为148mAh/g。LiMn?O?具有约4V(vs. Li/Li?)的电位,表现出优异的循环性能并在高倍率下保持容量。因此,LMO是高功率锂离子电池的有前景的候选材料。这种尖晶石结构的主要问题来自于杨-特勒(John–Teller)效应和Mn??在电解质中的溶解,导致不可逆的结构退化和容量衰减。
为改善电化学性能并弥补不足,其他元素被引入锰基尖晶石框架,形成LiM?.???Mn?.???O?(M = Al、Ti、Cr、Fe、Co、Ni、Cu和Zn)。例如,镍替代的尖晶石材料,表示为LiNi?.?Mn?.?O?,被认为是一种有前景的高电压尖晶石正极,因为它在~4.7V(vs. Li/Li?)通过Ni??/Ni??双重氧化还原工作,理论容量为147mAh/g,实际容量为125mAh/g。
多阴离子正极材料
多阴离子正极由过渡金属多面体和多阴离子基团组成的三维网络构成。多阴离子正极由于共价键合的氧原子而具有高热稳定性。最广泛研究的多阴离子正极是具有有序橄榄石结构的磷酸盐(LiMPO?,M = Fe、Mn、Co或Ni)。LiFePO?(LFP)是橄榄石磷酸盐中研究最广泛和发展最完善的材料。
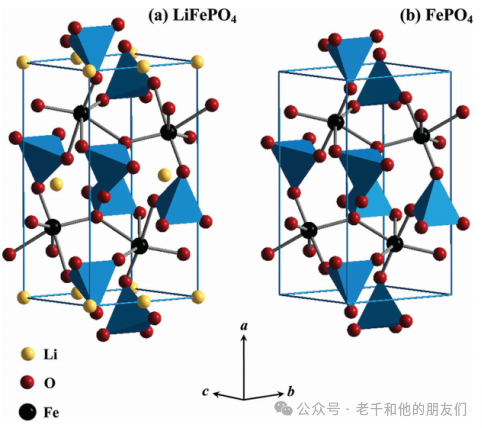
如图6所示,在充电过程中,由于脱锂,LFP变成FePO?,而在放电过程中,由于锂化,FePO?到LFP的可逆转化发生。LFP表现出120-160mAh/g的实际比容量(理论容量:170mAh/g),3.4V(vs. Li/Li?)的平稳工作电压和长循环寿命。然而,低内在电子导电性和慢的一维锂扩散率限制了倍率性能。因此,LFP通常被碳涂覆或与其他导电剂混合以增强倍率能力。
图6 (a) LiFePO4和(b) FePO4的晶体结构(磷的PO4环境已表示为四面体)
除了磷酸盐外,硅酸盐(Li?MSiO?)、氟磷酸盐(LiVPO?F)和氟硫酸盐(LiMSO?F)也被探索作为锂离子电池的多阴离子正极。
无序岩盐正极
无序岩盐结构的正极,特别是阳离子无序岩盐(DRX),是一种新型高能量密度正极材料。DRX中的三维主体结构相当稳定,因为随机的阳离子分布消除了层间距的变化。基于DRX的氧化物和氧氟化物通常由地球上丰富的元素组成,同时具有无钴化学性质、广泛的组成空间和大的电荷存储容量。一些DRX能够提供超过300mAh/g和1,000Wh/kg的可逆容量和能量密度。金属氧化物的电子导电性限制了正极材料的倍率性能,这可以通过各种策略来改善。还应注意的是,碳涂层可以改善基于V、基于Mn和基于Co的DRS氧化物的锂扩散系数。
转化型正极材料
与嵌入型正极不同,转化型正极中的化学键在电化学反应过程中重复断裂和重组。此外,由于多电子转化反应,转化型正极可以在每个金属中心存储多个锂离子,从而导致比传统正极高三到五倍的容量。在几种类型的转化材料中,金属氟化物由于其高理论电位(3.55V [vs. Li/Li?],CuF?)和质量比容量(713mAh/g,FeF?)而最具前景。然而,过渡金属氟化物由于过渡金属-氟键的离子特性引起的大带隙而具有较差的离子和电子导电性。通过利用各种碳复合材料、阳离子和阴离子替代以及纳米结构化,已经取得了相当大的性能改进。
硫和氧气
硫(S)提供1,675mAh/g的理论比容量和2.15V的平均电压(相对于Li/Li+)。此外,低成本和丰富的储量也赋予了硫显著的竞争优势。应当注意的是,硫是一种无锂正极材料。Ji及其合作者通过在硫正极中引入高度有序的纳米结构介孔碳主体,实现了高达1,320mAh/g的可逆容量,这引起了人们对锂硫电池的热情。
然而,硫正极存在一些固有缺点,如电绝缘的硫及其反应产物Li2S、液体电解质中可溶性锂多硫化物的严重穿梭效应,以及锂化/脱锂过程中由体积变化引起的电极开裂和粉化。为解决这些问题,已经进行了多项努力,包括:(i)具有化学/物理限制功能的硫载体、中间层和改性隔膜;(ii)分子设计的活性材料;(iii)降低多硫化物溶解度的先进电解质;(iv)具有动力学加速功能的催化剂/氧化还原媒介;以及(v)负极保护。
氧气是一种可以从空气中获取的气态活性材料,能够显著降低工作电池的总重量。此外,O2和Li之间的转化反应可以提供高储电容量。典型的锂空气电池可以实现最高的质量能量密度,理论能量密度为3,500 Wh/kg,实际能量密度为950 Wh/kg。然而,电解质不稳定性、空气电极的降解和锂负极的不稳定性导致系统的循环性能差和能量效率低。升级电解质、保护金属锂负极和设计催化剂可以用来解决这些问题。
锂离子电池的负极材料
提高锂离子电池能量密度的另一个有效方法是寻求高容量负极材料。基于电化学锂化/脱锂机制,锂离子电池中使用的负极大致分为三类:嵌入型负极、合金型负极和转化型负极。
嵌入型负极——碳基材料
碳基材料,包括天然/合成石墨和软/硬碳,由于其成本低、储量丰富、脱锂电位低(相对于Li/Li+)、锂扩散性高、电导率高以及锂化/脱锂过程中体积变化小,成为锂离子电池最可行的候选材料。值得强调的是,碳基负极使锂离子电池在约40年前成为商业可行的产品,而且碳仍然是作为负极材料的最理想选择。例如,传统的石墨负极具有三维结构稳定、能量密度适中、理论质量容量为372mAh/g、理论体积容量为735 mAh/cm3以及低成本的优点。
迄今为止,石墨是商业锂离子电池的主要负极材料。在充电过程中,来自电解质的Li+离子渗透到碳中并形成锂/碳嵌入化合物,即LixC,这是一个可逆反应,每6个碳原子储存1个锂原子。需要注意的是,碳的质量容量比大多数正极材料高,但商业石墨的体积容量仍然较低,范围在330到430 mAh/cm3之间。此外,还开发了纳米结构碳基负极材料,如一维纳米管、纳米线、纳米纤维、二维石墨烯和多孔碳基负极,以提高锂离子电池的能量和功率密度。
插入型过渡金属氧化物负极
最经典的插入型过渡金属氧化物负极是基于钛的,例如Li4Ti5O12(LTO)和TiO2,其中氧化还原中心在锂化时被还原为Ti3+,随后在碱金属阳离子脱出时重新氧化为Ti4+。尖晶石结构的LTO每单元可存储多达三个Li+离子,经历从尖晶石到岩盐结构的可逆两相反应,产生175mAh/g的理论容量,对应于化学式Li7Ti5O12。Li4Ti5O12和Li7Ti5O12的结构如图7所示。
图7 (a)尖晶石结构的Li4Ti5O12,其中蓝色四面体代表Li,绿色八面体代表无序分布的Li和Ti;以及(b)岩盐结构的Li7Ti5O12,其中蓝色八面体代表Li,绿色八面体代表无序分布的Li和Ti。
LTO表现出较小的体积变化(~0.2%),被认为是零应变材料,这导致优异的循环性能。此外,高脱锂电位(1.55V vs. Li/Li+)可以防止锂枝晶的生长并保证基于LTO的锂离子电池的安全性。此外,锂离子扩散系数比石墨高一个数量级,确保了优异的倍率性能。
然而,LTO具有固有的较差电子导电性,这阻碍了倍率性能。通常采用两种不同的方法来提高倍率性能:通过表面改性或离子掺杂来增强离子扩散和电子导电性,从而加速电荷转移反应,以及通过设计纳米结构LTO负极来减少锂离子在体相中的扩散距离。
此外,各种结构的TiO2也被探索作为锂离子电池的负极材料。由于沿[010]方向的特性平行通道,TiO2-B纳米管或纳米线被认为是用于锂离子嵌入和扩散的最具吸引力的结构之一。
合金型负极
自从A. Dey证明锂金属可以在有机电解质中与其他金属在室温下进行电化学反应以来,锂与不同金属或半金属元素和化合物之间的合金化反应被广泛研究。第IV族元素,特别是Si和Sn,由于形成高容量富锂二元合金和低工作电位(石墨除外),成为合金化反应的主要研究对象。Si和Sn的理论容量分别为3,579和994mAh/g,显示出对下一代锂离子电池的潜力。
硅和硅基化合物
纯硅负极与锂的反应机理可解释如下:
放电过程:Si(结晶态) + xLi+ + xe- → LixSi(非晶态)
(3.75-x)Li+ + (3.75-x)e- → Li15Si4(结晶态)
?
充电过程:Li15Si4(结晶态) + y → Si(非晶态) + yLi+ + ye- + Li15-ySi4(残留)
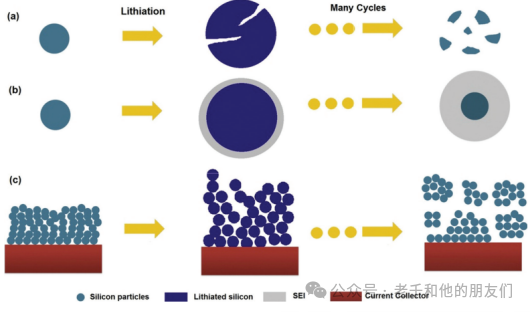
在第一次放电的所有阶段都观察到上述两相反应,并在完全形成二元合金(Li15Si4)后完全消失。因此,在随后的循环中只观察到单相反应。然而,硅在锂化/脱锂过程中伴随着剧烈的体积膨胀(300%-400%)和巨大的应力产生,导致一系列严重的破坏性后果:(i)由于重复的充放电过程中逐渐增强的粉化,电极的结构完整性受到破坏;(ii)由于界面应力的存在,电极与集流体之间的连接断开;以及(iii)在固体电解质界面(SEI)层持续形成-破裂-重新形成过程中,锂离子持续消耗(图8)。
图8 硅电极的三种不同失效机制:(a)电极粉化,(b)SEI层的持续破裂和重新生长,以及(c)整个电极的崩塌。
已经开发了几种设计策略来开发纳米结构硅负极并克服这些问题,因为(i)纳米结构硅负极可以在电池操作中避免机械断裂,(ii)纳米结构硅与纳米结构碳的结合,如典型的蛋黄壳或管中线结构,可以确保电池操作过程中高效的电子和离子传输,以及(iii)纳米结构硅与碳的共价键合可以减少由活性材料与集流体分离引起的意外断连。
此外,一氧化硅(SiO)也被视为锂离子电池的负极候选材料。SiO在充放电过程中的绝对体积变化比硅小。此外,锂插入形成的几种含氧化合物有望在缓解体积变化方面发挥基质作用。
锡(Sn)和锡基化合物
1997年,日本富士胶片Celltec有限公司宣布其Stalion电池使用锡基非晶氧化物作为负极。该材料由Sn-O作为锂插入的活性中心和其他形成玻璃的元素组成,可提供>600mAh/g的质量容量,鼓励更多研究人员从事锡基材料研究。
锡基氧化物材料的基本反应机理可表述如下:
SnO + 4Li+ + 4e- → Sn + 2Li2O
Sn + 4.4Li+ + 4.4e- Li4.4Sn + 2Li2O
SnO2 + 4Li+ + 4e- → Sn + 2Li2O
Sn + 4.4Li+ + 4.4e- Li4.4Sn + 2Li2O
从Sn到完全锂化的Sn(Li4.4Sn)的转变过程中,体积变化约为260%,这是锡负极容量急剧衰减的主要原因。在充放电过程中,一种锂锡相以另一种为代价而生长,不同锂锡合金之间的晶格参数和结构差异导致应力/应变的积累和释放,引起颗粒开裂、SEI重新形成、与集流体连接丧失和电极失效,导致循环性能的快速恶化。已经做了大量努力来克服这些问题,包括设计和探索具有不同尺寸、形状和孔隙率的锡基化合物。
多年来,研究人员报道了各种基于锡的氧化物或氧化物玻璃,它们具有高容量、优异的循环稳定性和卓越的倍率性能。然而,其初始库仑效率仍需提高。例如,Dahn等人研究了基于锡的化合物的电化学性能以及锂与不同锡氧化物玻璃反应过程中的结构变化,证明了在首次循环中存在显著的不可逆容量损失(200-700mAh/g)。
除了使用锡氧化物作为非活性分散剂外,另一种方法是从基于锡的合金开始。2005年,索尼发布了采用纳米结构Sn-Co-C基负极的Nexelion 14430型电池。索尼声称,与传统锂离子电池相比,其体积容量可以提高30%以上。
2011年,索尼宣布推出另一代Nexelion电池(18650型电池),在2.0V-4.3V电压范围内,容量为3.5 Ah,体积能量密度为723 Wh/L。此外,受索尼Sn-Co-C负极成功的鼓舞,研究重点转向锡-过渡金属合金,如Sn-Cu、Sn-Ni、Sn-Fe和Sn-Co合金。
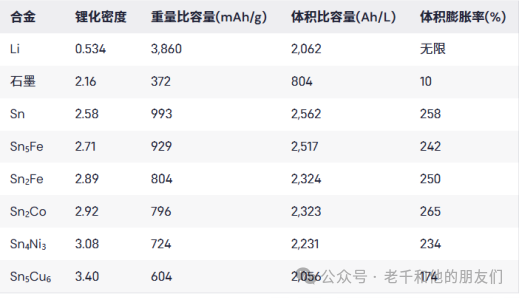
表1总结了Sn、Sn5Fe、Sn2Fe、Sn2Co、Ni3Sn4和Cu6Sn5形成Li4.4Sn+M时的锂化密度、质量容量和体积容量,并与锂金属和石墨进行了比较。
表1锡、Sn?Fe、Sn?Fe、Sn?Co、Ni?Sn?和Cu?Sn?合金的锂化密度、重量比容量和体积比容量
转化型负极
转化是一种可逆的电化学反应(通常称为置换反应),其中过渡金属化合物(MXy,X = P、S、O、F或Cl)在电化学过程中被破坏并随后还原为金属(M0)。当用作锂离子电池的负极时,过渡金属化合物(如氧化物、磷化物、硫化物和氮化物(MxNy;M = Fe、Co、Cu、Mn、Ni和N = O、P、S和N))的电化学反应机理是过渡金属的还原(氧化)以及锂化合物(LixNy;N = O、P、S和N)的组成(分解)。
电化学转化反应可描述如下:
MxNy + ze- + zLi+ M + zLiyNy,
其中M = Fe、Co、Cu、Mn、Ni,N = O、P、S和N。
基于转化反应的过渡金属氧化物(TMOs),包括Fe2O3、Co3O4、MnO、CuO和NiO,是锂离子电池的典型负极材料。这些化合物的优点是在充放电过程中体积变化较小,且由于过渡金属氧化物转化为过渡金属和锂氧化物过程中每个过渡金属的多电子转移反应,它们具有高容量(Fe2O3约1,000mAh/g)。然而,基于转化反应的TMO负极的工业化受到其较差的电导率和循环性能的阻碍。
与合金负极类似,转化型负极也存在材料颗粒级别的粉化、不稳定的SEI层以及电极级别的形态和体积变化等问题。为了实现转化氧化物的循环,需要采用纳米设计策略实现多固相的相互转化。
金属锂负极
除了上述金属和化合物外,金属锂也可用作负极材料。事实上,金属锂在锂电池研究初期就已被使用,包括20世纪70年代由埃克森美孚的Stanley Whittingham开创的第一个可行的锂离子电池。金属锂是终极负极选择,因为它具有最高的理论容量(3,860mAh/g或2,061 mAh/cm?),低密度(0.59 g/cm?)和最低的电化学电位(相对于标准氢电极为-3.04V)。
此外,锂金属负极对于锂硫和锂空电池系统不可或缺,这两种系统都正在被广泛研究用于下一代能量存储应用。与石墨负极的嵌入/脱嵌机制不同,锂金属负极中发生的是金属锂与锂离子之间的转化反应。
一旦负极被锂金属取代,使用含锂过渡金属氧化物作为正极的锂离子电池的比能量可从280提高到约440 Wh/kg,而锂硫和锂空系统可进一步将比能量提高到约650和约950 Wh/kg。锂空电池的体积能量密度接近汽油。
然而,不可控的锂枝晶生长导致短寿命和灾难性的安全隐患,限制了锂负极的实际应用。已采用一些有效策略来克服这些挑战,包括电解质改性、引入保护层、纳米结构负极和膜修饰。尽管实验结果令人鼓舞,但由于锂金属的活泼性质,在实际电池应用中仍有很长的路要走。
电解质
电解质在所有电化学设备中都是无处不在且不可或缺的。电解质的作用是作为在正极和负极之间传递电荷的媒介。电解质与其他组件(包括正极、负极和隔膜)紧密接触。界面,主要是电解质与电极之间的界面,通常决定了锂离子电池的性能。因此,电解质必须对正极和负极表面都表现出稳定性。
锂离子电池理想的电解质应满足以下要求:高离子电导率、宽电位范围内的电化学稳定性、化学稳定性、热稳定性、成本效益、简单的制备过程、低毒性和环保性。此外,电解质的电化学工作窗口应被修改以开发高电压正极和低电压负极材料。
鉴于电极-电解质界面对电池性能的重要性,电极/电解质界面,即固体电解质界面(SEI)和正极-电解质界面(CEI),它们分别通过电解质在负极/电解质和正极/电解质界面的电化学分解形成,将首先被简要介绍。
电极/电解质界面
一般来说,电极-电解质界面可以被视为覆盖在电极颗粒上的薄膜,由电解质的分解反应形成,保护活性材料免受后续降解机制的影响。
负极-电解质界面,称为固体电解质界面(SEI),影响锂离子从溶剂化相进入固相的过程,构成了大多数电极材料锂化过程的速率限制步骤。
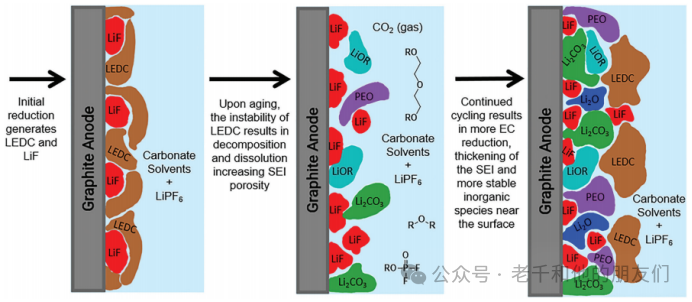
负极材料的电化学工作电位低于锂基电池电解质中常用的有机碳酸盐的还原电位(约为~1V vs. Li/Li+)。在电池充电过程中,电解质的电化学还原发生并在负极表面产生钝化SEI层。初始SEI组分的分解反应以及老化过程中SEI组成的观察变化,导致了以下SEI演变机制的提出(图9)。
图9 石墨负极上初始SEI形成的示意图,酸介导的热分解反应对SEI结构的影响,以及电解质的进一步还原导致SEI增厚的过程。
SEI是锂离子导体但电子绝缘体,导致SEI在一定厚度下停止生长。稳定的SEI层由于表面钝化效应,允许高库仑效率和负极的长期稳定性。然而,由于锂化和脱锂过程中重复的大体积变化,电极/电解质界面显著移动和变化,使得为高容量电极材料维持稳定的SEI变得极具挑战性。
在其他电池化学体系中,如石墨和硅负极电极,SEI形成过程仅涉及电解质在电极上的电化学还原分解,因为石墨和硅具有化学稳定性。锂金属上SEI的形成包括化学和电化学反应。因此,尽管锂金属上形成的SEI与石墨和硅电极上形成的SEI具有相似功能,但两类SEI之间的基本区别不应被忽视。
与SEI不同,CEI的研究较少,因为大多数正极的工作电位与商业碳酸盐电解质的热力学稳定窗口没有太大偏差。随着高电压锂离子电池的发展,当截止电压超过电解质的氧化稳定性时,电解质将在正极表面氧化和分解。由于高电压操作的要求,对CEI的理解变得越来越重要。然而,CEI的精确结构和组成仍存在争议,其结构和化学性质如何影响电池安全性尚未被完全理解。对于不同正极材料的CEI形成,通常提出交换反应和亲核反应机制。
有机电解质
有机电解质或非水系电解质,通常由锂盐溶解在有机溶剂或溶剂混排物中组成,是锂离子电池中最常用的电解质,因为它们具有高离子电导率和对多孔隔膜及电极的优良润湿性。
当第一个锂嵌入式正极材料,即TiS?被发明时,由于TiS?的工作电位适中(<3.0V vs. Li/Li?),处于醚类稳定性范围内,因此使用了醚类电解质(二氧戊环中的LiClO?)。当层状过渡金属氧化物被用作高压正极材料时,电解质从醚类转向酯类,因为酯类对正极具有良好的氧化稳定性,且能溶解多种锂盐以提供良好的离子电导率。
在所有酯类电解质中,碳酸丙烯酯(PC)和碳酸乙烯酯(EC)是两种常用溶剂。1990年索尼商业化的第一代锂离子电池使用无定形碳作为负极,采用了基于PC的电解质。另一方面,当石墨用作无定形碳的替代品时,开发了基于EC的电解质。此外,LiPF?因其平衡的性能而被广泛用作有机电解质中的锂盐,适用于不同的电池环境。最终,大多数商业锂离子电池使用LiPF?溶解在EC和线性碳酸酯(如碳酸二甲酯(DMC)、碳酸二乙酯(DEC)或碳酸甲乙酯(EMC))的混排物中。
此外,电解质添加剂通过引导SEI形成、提高电解质离子电导率、增加LiPF?热稳定性以及保护电极免受溶解和过充等方式,能有效提高锂离子电池的性能和循环寿命,已被广泛应用于电解质配方中。
电解质添加剂通常是无机化合物和具有各种官能团的有机化合物,如不饱和碳键、含硫组分、含卤素组分和其他组分。一般来说,对于负极,电解质添加剂在高于电解质溶剂的电位下还原并钝化电极表面,防止电解质溶剂进一步还原;对于正极,电解质添加剂预期在溶剂之前氧化并覆盖电极表面,防止电解质的氧化分解。
考虑到不同类型的电极材料,电解质添加剂的选择可能会改变。例如,含氟和含磷电解质添加剂是能够改善高压正极材料性能的有前途的物质,而丁基砜可以改善LiFePO?的低电子电导率及其在低温下的倍率性能。
水系电解质
相比易燃的有机电解质,使用具有高离子电导率的水系电解质在成本、环境和安全性方面具有优势。因此,Dahn小组首先使用硝酸锂水系电解质,在5M LiNO?电解质中采用VO?负极和LiMn?O?正极构建了水系锂离子电池,平均工作电压为1.5V,能量密度约为55Wh/kg。然而,可能发生的H?或O?析出的副反应以及电极材料与水或溶解的O?的溶解/副反应常导致低库仑效率和差的循环性能。此外,各种金属氧化物正极,如LiCoO?、LiMn?O?或NMC,在水系电解质中表现出pH敏感性。
最近,通过在水中添加高浓度的不同盐类开发了"水中盐"电解质。Wang小组首先证明,通过使用合适的阴离子(N(SO?CF?)??或TFSI?)操控Li?离子溶剂化结构,降低水的电化学活性,可以提高水分解的阳极和阴极极限。首次充电过程中在电极和电解质之间形成的界面将电化学窗口扩展到约3.0V。应该注意的是,水中盐电解质使用高浓度盐阻碍了实际应用。因此,研究工作应致力于降低电解质成本,同时不牺牲SEI形成能力和增加水活性的独特特性。
离子液体
离子液体(ILs)由阳离子和阴离子组成,不含任何溶剂,具有低熔点和良好的离子电导率。不同的阳离子,如咪唑鎓、季铵、吡咯烷鎓和哌啶鎓,与阴离子如PF??、BF??和双(三氟甲磺酰)亚胺(TFSI?)结合,为电解质应用提供不同的性能。近来,室温离子液体因其宽广的电化学操作范围、无挥发性和改善的热稳定性而受到更多关注。然而,与商业有机电解质相比,它们也存在较差的功率性能。因此,在商业化之前还有很多工作要完成。
固态电解质
传统锂离子电池因使用高度易燃、热稳定性低和闪点低的有机液体电解质而存在严重安全问题,容易导致火灾事故和爆炸。因此,正在开发固态电解质(SSEs)以追求具有高能量密度和改善安全性的下一代能源存储设备。
与液体电解质相比,固态电解质不挥发、不易燃且具有高热稳定性,使其适用于广泛的操作温度范围。固态电解质提供了一个物理屏障层来分离正极和负极,并防止在高温或冲击下的热失控。此外,固态电解质可以通过有效抑制锂枝晶的形成,实现锂金属负极的成功利用。
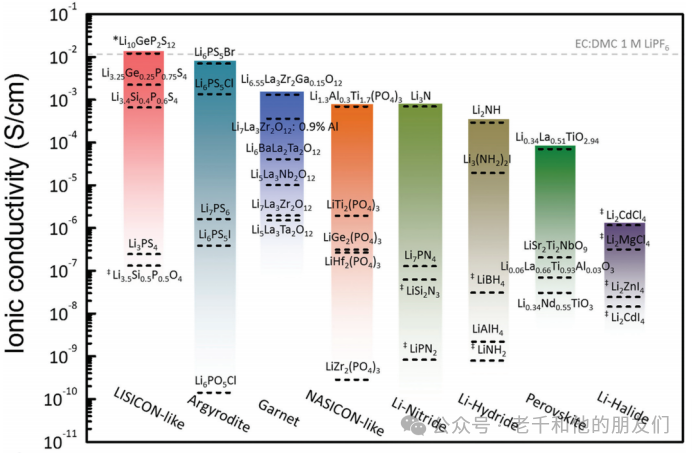
为满足商业要求,高离子电导率、良好的机械性能和与电极的出色界面稳定性是固态电解质最基本的要求。因此,已开发了几种类型的固态电解质,包括无机固态电解质(钠超离子导体型、钙钛矿型、石榴石型和硫化物型)、聚合物和复合固态电解质以及薄膜固态电解质。图10比较了选定无机固态电解质与典型有机液体电解质的锂离子电导率。一些结构家族,如LISICON类、银黄晶石和石榴石,在室温下可实现10??至10??S/cm范围内的高离子电导率,而每个结构家族内的Li?电导率可能存在高达5-6个数量级的巨大差异。
图10无机固态电解质和典型有机液态电解质的锂离子电导率。
总结与展望??
本文简要介绍了锂离子电池以及超越锂电池的发展,并总结了锂离子电池正极、负极和电解质材料的发展。
未来锂离子电池和其他可充电电池的发展应考虑以下几个方面:
i. 应通过探索新型材料并扩展我们对结构-成分-性能-表现关系的基本理解,进一步开发高能量密度、高容量和高电压的正极材料。值得强调的是,追求高容量正极材料是提高电池能量密度最有效的方法,而高电压正极材料可以降低锂离子电池模块的复杂性。对于负极材料,混排多种材料以追求互补特性应该是一个发展方向。
ii. 快速充电或超快速充电(XFC)是提升用户充电体验的关键驱动力和长期战略目标。根据美国先进电池联盟(USABC)的标准,快速充电是指在15分钟内使电池达到80%的充电状态,这意味着电池组可以以4C或更高的速率充电至80%的SOC。虽然大多数商业锂离子电池的最大充电速率仅限于3C,但应探索快速充电的正极和负极材料。
iii. 对成分和/或结构演变与电池性能之间关系的全面理解仍然有限。过去十年里,创新的实验和建模方法在多尺度上研究复杂材料的应用呈爆炸性增长。然而,先进的表征技术(即原位和同步操作工具、低温电子显微镜)和理论/计算分析对于电池材料的进一步发展仍然是必需的。
iv. 高温和低温环境都会严重影响电池容量和使用寿命。在高温环境中,锂离子电池可能产生热失控,导致短路、燃烧、爆炸和其他安全问题。另一方面,在低温下,锂离子电池中可能出现锂枝晶,导致短路、启动失败和其他操作故障。因此,高效的电池热管理系统(BTMS)对于最大化电池模块/组的寿命具有至关重要的意义。
v. 锂离子电池的可持续回收技术已部分建立;然而,回收技术远未成熟,改进锂离子电池的回收技术是一项持续的努力。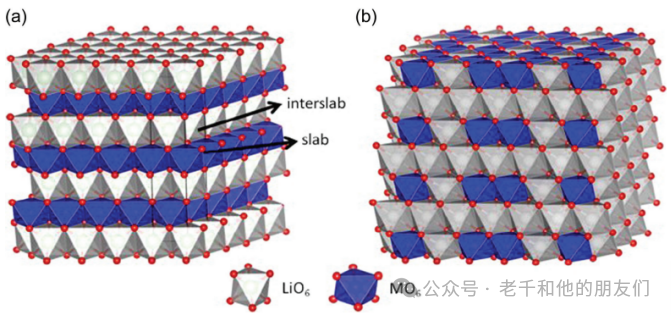
-
锂离子电池
+关注
关注
85文章
3460浏览量
79171 -
电极
+关注
关注
5文章
843浏览量
27935 -
电池
+关注
关注
84文章
11106浏览量
135591
原文标题:锂离子电池技术解读 | 入门指南
文章出处:【微信号:bdtdsj,微信公众号:中科院半导体所】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录





 一文详解锂离子电池技术
一文详解锂离子电池技术











评论